近年来,随着国家相关支持性政策陆续发布以及资本助力,我国医疗器械行业蓬勃发展,医疗器械CRO行业也同时实现了快速发展。CRO作为连接医疗器械企业、医疗卫生机构等各方的重要桥梁,凭借众多服务优势,已然成为医疗器械产业链中的关键一环。
连接产业上下游
医疗器械CRO是连接医疗器械产业链上下游的重要桥梁,其上游包括医疗卫生机构、科学仪器厂商、实验动物供应商等;下游主要是医疗器械企业。上游机构主要为医疗器械CRO提供临床试验数据、科学实验仪器及实验动物资源等;医疗器械CRO为下游医疗器械企业提供从临床前研究、临床试验、注册申报到上市后管理覆盖全生命周期的专业化服务,以满足医疗器械开发所特有的试验需求和监管要求,帮助医疗器械企业缩短研发周期,降低研发成本及研发风险,为推动医疗器械产品成功上市、规范上市后管理提供助力。
医疗机构:医疗器械临床试验机构规范化、专业化管理,为医疗器械CRO行业发展创造良好环境
2017年11月,《医疗器械临床试验机构条件和备案管理办法》(以下简称《管理办法》)正式发布。根据《管理办法》,对符合医疗器械临床试验质量管理规范要求且具备开展临床试验能力的医疗器械临床试验机构,实行备案管理。自2018年《管理办法》实施以来,医疗器械临床试验机构备案数量持续增长。根据国家药监局统计数据,截至目前,共有1236个临床机构完成备案。作为医疗器械CRO的上游环节,专业化、规范化的临床试验机构将持续提高医疗器械临床试验质量,为医疗器械CRO行业发展创造良好环境。
医疗器械CRO:目前我国医疗器械CRO行业集中度较低,多以中小型企业为主
我国医疗器械CRO行业起步较晚,企业数量众多,以中小型企业为主,市场集中度较低。由于医疗器械CRO行业基础服务准入门槛较低,多数企业的业务范围主要集中于提供临床试验服务、注册申报服务等。在下游市场需求及国家政策的推动下,我国医疗器械CRO企业的服务范围和服务领域将持续拓展,逐渐覆盖医疗器械研发检测、动物试验、临床试验、注册申报、上市后管理全生命周期,同时行业将实现加速整合,市场持续扩容。
医疗器械企业:我国医疗器械生产企业数量逐年递增,行业实现稳步发展
国家药监局统计数据显示,截至2020年底,全国共有2.65万家医疗器械生产企业,较2017年增长18.3%;可生产第二、三类医疗器械的企业数量分别为1.30万家、2181家,呈逐年递增趋势,医疗器械行业整体实现稳步发展。作为医疗器械CRO的下游,医疗器械生产企业数量的增加,进一步催生了对医疗器械CRO的需求。
服务全生命周期
依据国家药监局和国家卫生健康委于2022年3月发布的《医疗器械临床试验质量管理规范》,在医疗器械临床试验开始前,申办者应当通过主要研究者向伦理委员会提交基于产品技术要求的产品检验报告。
医疗器械CRO通过整合实验室资源,搭建包括生物学评价、微生物与感染控制、电气安全与电磁兼容、临床前动物试验等在内的多个实验技术平台,建设相关技术能力,可充分满足医疗器械检验检测需求(详见表)。
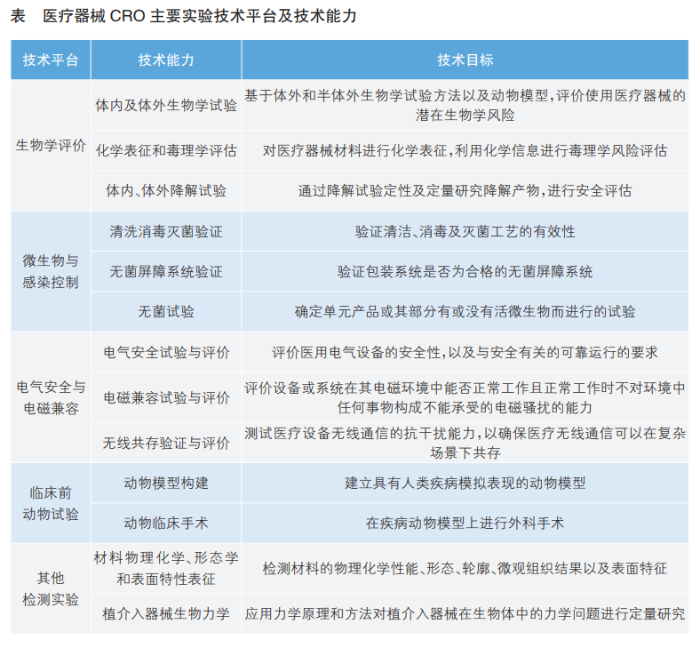
医疗器械CRO主要实验技术平台及技术能力
目前,体外诊断试剂相关服务是医疗器械CRO企业积极拓展的新兴业务领域。
我国医疗器械按风险程度实行分类管理,不同类别的医疗器械产品分别通过备案管理或注册管理实现有效控制。医疗器械CRO可依据医疗器械企业产品分类,提供定制化服务内容。
医疗器械CRO服务范围广泛,主要包括临床前的研发检测服务、动物试验服务,临床试验服务,注册申报服务,上市后的生产体系法规服务及产品迭代研发服务等,服务内容覆盖医疗器械全生命周期(详见图)。
在我国医疗器械CRO行业发展初期,多数CRO企业主要提供临床组合服务及注册申报服务。随着医疗器械行业快速发展,行业监管日趋严格和完善,医疗器械企业需求发生变化,从而推动专注于医疗器械生命周期其他阶段业务的医疗器械CRO企业不断涌现,其服务内容更加专业和细化,服务类型包括临床前阶段的研发试验与检测、动物试验等。
助力创新成果转化
医疗器械CRO作为专门服务于医疗器械领域的第三方外包组织,具有众多服务优势:拥有专业化且经验丰富的团队及规模化平台,可提供全生命周期服务,并通过与创新链各主体深度合作加快创新资源布局,有效帮助医疗器械企业缩短产品研发及上市周期,协助企业验证产品的安全性及有效性,降低研发风险和研发成本,助力医疗器械企业实现创新成果转化。
医疗器械CRO的专业化团队高度契合医疗器械产业发展特点,可帮助企业解决产品研发上市过程中的潜在问题
医疗器械产业是一个多学科交叉、多知识密集、多领域细分的高技术产业。多学科交叉体现在涉及生命科学、临床医学、电子科技、信息工程、材料科学等多个学科;多知识密集体现在医疗器械从研发到上市销售过程涉及设计开发、专利产权、法律法规、工艺开发、生产管理等多门类知识;多领域细分体现在医疗器械可依据用途划分为骨科器械、眼科器械、医疗影像设备、重症监护设备等。
医疗器械CRO拥有专业化团队,聚集了不同学科背景的专业人才,他们掌握医疗器械全生命周期涉及的各种专业知识,并且在不同医疗器械细分领域积累了丰富经验,高度契合医疗器械产业发展特点,可有效帮助医疗器械企业解决产品研发上市过程中的各种问题。
医疗器械CRO深植医疗器械领域,可提供全生命周期服务,帮助医疗器械企业降低失败风险
医疗器械的成功上市,需要经过产品设计研发、质量体系建立、检验检测、临床试验、注册申报、生产体系建立等阶段,过程漫长、失败风险高且投资巨大。医疗器械CRO作为专门为医疗器械企业提供专业化服务的第三方组织,深植医疗器械领域,服务范围覆盖医疗器械全生命周期。其通过整合优质资源,可很大程度上帮助医疗器械企业在产品研发过程中实现高质量研究和低成本投入,很好满足企业风险控制的需求,同时推动创新成果快速转化。
医疗器械CRO整合企业试验需求,规模化建设综合平台,相比企业自建实验平台更加高效
医疗器械关系人民群众身体健康和生命安全。医疗器械产品在开展临床试验前必须通过多种检测项目来评价其安全性及有效性,包括EMC电磁兼容检测、电气安全检测、生物相容性检测、微生物检测、包装材料检测等。不同的检测项目包括多项试验内容,如生物相容性检测可分为细胞毒性试验、刺激和致敏试验、全身毒性试验、植入试验、遗传毒性试验、发育毒性试验、血液相容性试验、生物降解试验等。不同试验对实验室及实验仪器设备的要求不尽相同。企业自建实验平台需要打造专门的试验团队,搭建一定规模的实验室,并配备相应的仪器设备,投入成本较高,且较难满足全部的试验需求。而医疗器械CRO通过建设规模化的综合实验平台,可整合医疗器械企业试验需求,充分利用实验室资源,相比于企业自建实验平台进行检测的模式更加高效。
医疗器械CRO为产业链的关键环节,深度融合创新链,加快创新资源布局,打造高科技创新闭环
创新链是指以某创新主体为核心,多主体协同配合,以满足市场需求为导向,从基础研究到产业化的创新过程的集合。创新主体构成复杂,包括企业、科研机构、高校、投资机构、政府、中介机构、推广机构、产业园区等。
医疗器械CRO作为医疗器械产业链的关键环节,深度融合创新链,通过与医疗器械企业、行业协会、临床医疗机构、高校、产业园区等进行合作,形成以政府宏观调控为导向,以政策制度为激励,以医疗器械CRO为桥梁,以高校、科研院所、科技金融服务机构为支撑的运行机制,推动产学研协同创新,加速创新资源布局,打造高科技创新闭环,帮助医疗器械企业进行创新成果转化。
未来,在医疗器械领域利好政策和市场需求的共同推动下,医疗器械CRO行业集中度将进一步提高,服务范围与服务领域将持续拓展,实现对医疗器械全生命周期的覆盖。
(来源:中国食品药品网)