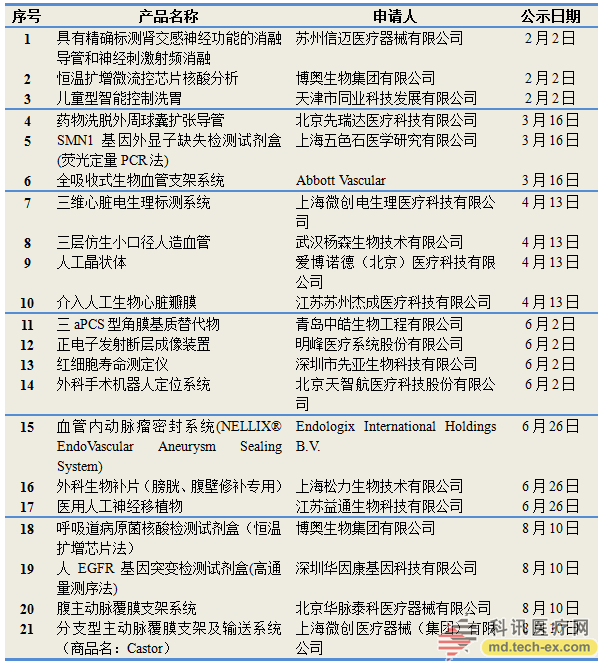
2015年8月10日,国家食品药品监督管理总局医疗器械技术审批中心(以下简称CMDE)发布了《创新医疗器械特别审批申请审查结果公示(2015年第6号)》,拟同意包括博奥生物呼吸道病原菌核酸检测试剂盒(恒温扩增芯片法)在内的3个申请项目进入特别审批程序。
至此,2015年CMDE已经在其官网上发布了六批结果公示,共21个项目进入特别审批程序。其中,仅博奥生物集团有限公司有2个项目入选。此外,从申请人所属地来看,北京、上海和江苏的入选项目数量处于领先位置。以下是21个入选项目具体名单:
2014年2月7日,CFDA发布了《创新医疗器械特别审批程序(试行)》,并于同年3月1日生效。该程序是在确保上市产品安全、有效的前提下,针对创新医疗器械设置的审批通道。 CMDE设立创新医疗器械审查办公室对创新医疗器械特别审批申请进行审查,审查时一并对医疗器械管理类别进行界定。
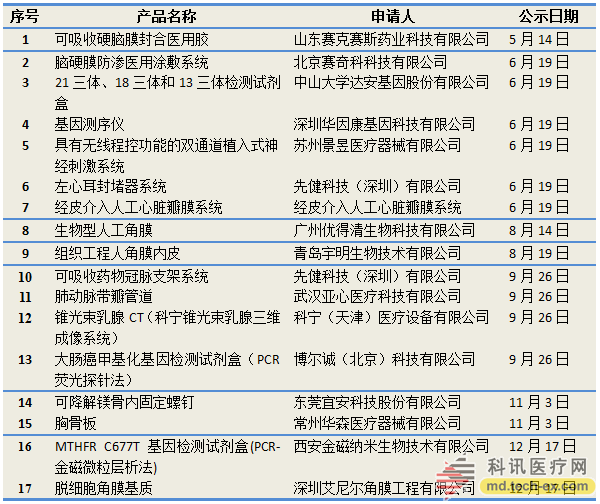
自《创新医疗器械特别审批程序(试行)》发布之后,2014年CMDE共发布了7次创新医疗器械特别审批申请审查结果公示,共有17个项目入选,包括中山大学达安基因股份有限公司的21三体、18三体和13三体检测试剂盒等。
据笔者统计,自2014年5月14日第一次公布山东赛克赛斯药业科技有限公司的可吸收硬脑膜封合医用胶成为首个入选特别审批程序的申请项目以来,目前已有38个产品进入特别审批通道,这一切反映了落实政策的具体行动。
2014年获批进入“创新医疗器械特别审批程序”的17项产品