随着美国众议院和参议院制订的《21世纪治疗法案》出台,患者将更快更方便获得新的医疗技术,这在2015年上半年医疗器械的获批数量中已有所体现。
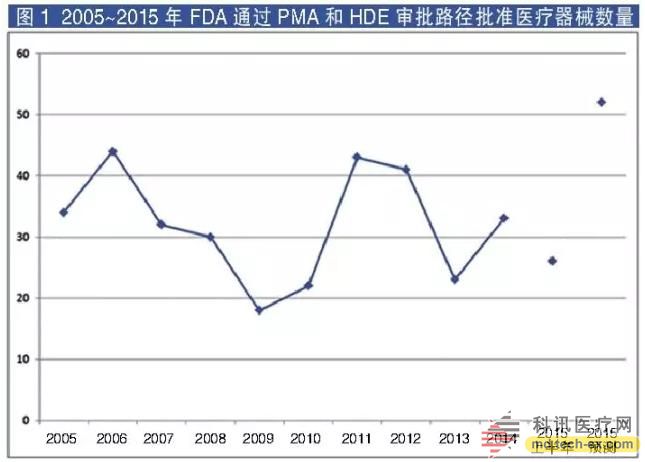
上半年已有26个医疗设备获得FDA上市前批准或税费减免,今年将有望看到比过去十年来更多的新产品获批上市(见图1)。
审批提速安全性受质疑
美国FDA器械审批PMA路径的快速审批程序于4月开始生效。然而,这一措施目前并未受到大众的欢迎。《纽约时报》7月17日一则社论指出,由于《21世纪治疗法案》放低了对临床数据的考量,可能会使得安全性较低的医疗技术通过审批。
这一警告是由两名心脏病专家提出的。截至目前,今年心脏病治疗领域通过PMA快速审批通道和HDE器械审评通道(人道主义器械豁免)获批的有11个心脏病器械批文,与2014年全年的数量相同。
2015年上半年心脏病诊疗器械审批的平均时长为15.2个月,快于所有种类器械审批时长平均水平的17.1个月。另外,诊断成像和伤口愈合管理设备的审批时长也短于平均水平。
FDA对于新型和高风险设备的审评审批是否足够严谨,还值得商榷。但业内普遍认为,FDA的审批要求比欧洲监管机构更为严格。值得注意的是,2015年上半年所有通过PMA或HDE通道的设备平均获批时间为17.1个月,与去年的16.7个月相比还稍长一点。
相比PMA,HDE通道显得效率更高。人道主义器械豁免通道是专门为罕见病医疗器械的审批设置的。针对患者人数少于4000名的仪器设备审批,能够申请这一审批程序。Kaneka公司的Lixelle,是用于治疗一种由蛋白质折叠引起慢性肾衰竭的罕见病的血液过滤器,该公司花了两年多的时间获得HDE通道审批,而奥梅德(Abiomed)公司的Impella RP右心室心脏泵仅花了4.4个月时间就通过HDE通道获得审批。这是2015上半年仅有的两个HDE通道批件,使得这些审批平均时长降至14.7个月,远快于PMA通道的17.3个月。
激励创新成效显著
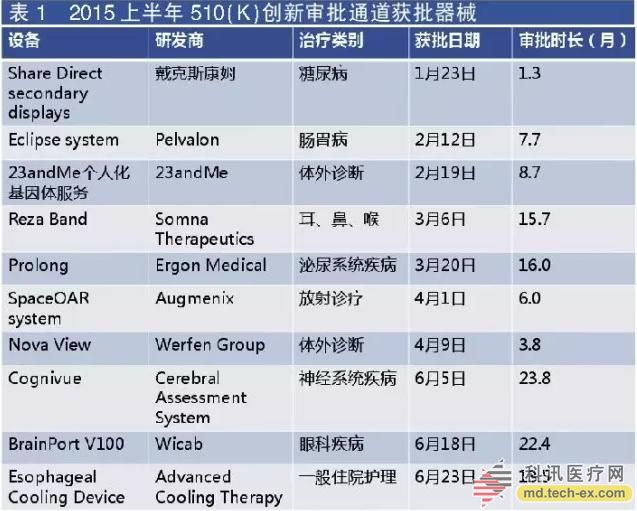
低风险的器械通常是通过510(k)通道审批,是另一条更快捷的新型医疗器械审批通道(de novo clearance),开放给而那些与以往的技术差别很大的设备。2015上半年通过创新医疗器械审批程序的器械有10个,仅略低于以往年平均值。
创新医疗器械审批程序具有相对较低的安全性和有效性。符合条件的产品其风险为中低级,其安全性与有效性应有“合理的保证”。研发商必须标示出该器械的已知风险和效用,并提供相应证据以表明这些风险是能够得到有效缓解,而其有效性是有保证的。
因此,有一些新奇的新医疗器械通过这一途径进入市场。美国威斯康辛州的Wicab公司研发的BrainPort V100帮助失明人士定位和移动。该系统包括一组由用户用嘴部固定的电极,其连接着一副安装了摄像头的太阳眼镜。摄像视频中的像素可转变成电脉冲,患者则通过舌头进行感知。一些用户体验后表示这感觉就像是微小的气泡涌动。
最快通过审批的创新医疗器械则会成为世界最新的顶尖产品。由戴克斯康姆公司(DexCom)研发的可共享辅助显示应用程序APP,成为首个获批成为医疗器械的移动应用程序,其在今年1月26日获得FDA的批准,有患者与其护理者分别使用不同的APP类型。这个能够使用户持续监测病人血糖水平变化的产品,其审批时长仅为1.3个月。
这个时间表也许很快就会被刷新。可以预见的是,2015下半年将有更多的新型器械获得审批,2015年将刷新一个新的记录。
(来源:医药经济报)


